近日,我院杨倩教授团队在国际著名期刊 Proceedings of the National Academy of Sciences(PNAS,IF=9.4)发表研究论文 《Goblet cells dictate viral tropism and pathogenesis in nasal and intestinal mucosae》。该研究以猪流感病毒(SIV)和猪流行性腹泻病毒(PEDV)为模型,系统阐明了杯状细胞在病毒黏膜感染过程中的核心调控作用,揭示了不同黏膜组织中病毒嗜性和致病结果截然不同的关键宿主机制。
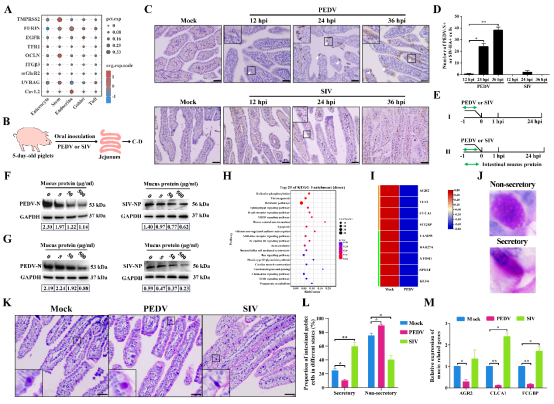
图1. 杯状细胞黏液分泌功能影响PEDV和SIV在肠道黏膜的嗜性
作为黏膜上皮的重要组成,杯状细胞传统上被视为“黏液提供者”。然而该研究表明,它们在病毒能否建立有效感染、是否能够扩散、以及是否引发黏膜损伤方面发挥决定性作用。研究发现,尽管SIV与PEDV均可接触并感染鼻腔上皮,但其感染命运显著不同:PEDV在鼻腔仅维持短暂、局灶的感染,并迅速被黏液屏障清除;SIV则能突破基底膜进入固有层,实现更深层的组织扩散。
单细胞测序结果显示,两种病毒在鼻腔上皮中的受体表达水平并无显著差异,这意味着传统受体理论无法解释其不同的组织嗜性。相反,真正决定两者感染模式的,是杯状细胞对黏液分泌状态的精准调控——PEDV增强黏液分泌从而抑制自身扩散,而SIV抑制黏液分泌,使其在黏膜中更易传播。
在肠道黏膜中,研究揭示了PEDV更为独特的致病机制。PEDV可通过激活黏膜下神经元的乙酰胆碱-CHRM3信号通路,诱导杯状细胞形成 GAP(Goblet Cell–Associated Antigen Passage)通道。这一本用于递送食物抗原、维持免疫耐受的生理通道在PEDV感染后出现“用途转移”——即便肠道上皮结构仍完整,肠道细菌也可通过GAP进入固有层,引发炎症反应,从而加剧肠道损伤并促进病毒扩增。值得注意的是,阻断CHRM3信号可显著抑制GAP形成,感染仔猪的腹泻、体重下降和组织病变均明显减轻,证明GAP在PEDV高致病性中的关键作用。
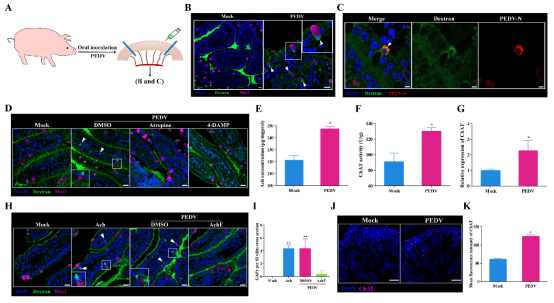
图2. 乙酰胆碱和CHRM3之间的相互作用驱动PEDV诱导的PGAP形成
该研究从鼻腔到肠道、从单细胞图谱到体内功能验证,构建了一个新的科学框架:病毒嗜性不仅由病毒本身及其受体决定,更由黏膜微环境,尤其是杯状细胞的功能状态所决定。因此,围绕杯状细胞的功能调控,包括增强黏液屏障、抑制GAP形成等,有望成为未来跨病毒种类、跨黏膜系统的广谱抗病毒策略,为呼吸道和肠道重要病毒的防控开辟新方向。
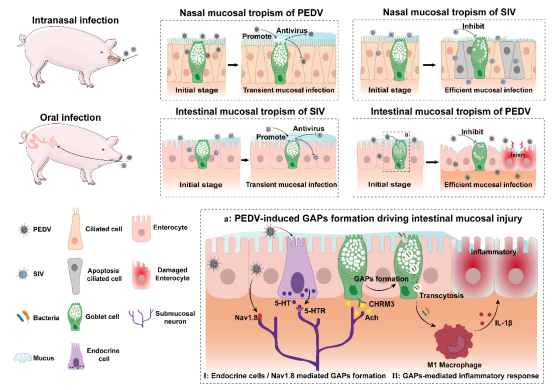
图3. 杯状细胞介导的 SIV 和 PEDV 黏膜嗜性及发病机制示意图
该论文第一作者为南京农业大学动物医学院博士研究生王文骞(现入职华中农业大学动物科技学院),通讯作者为南京农业大学李昱辰副教授。研究过程中,杨倩教授为课题提供了重要指导,课题组的林建教授和崔晓靓老师给予了宝贵建议。本研究得到了国家重点研发计划青年科学家项目、国家自然科学基金面上项目、江苏省优秀青年基金和中央高校基本业务费等项目的资助支持。

